水素結合の例
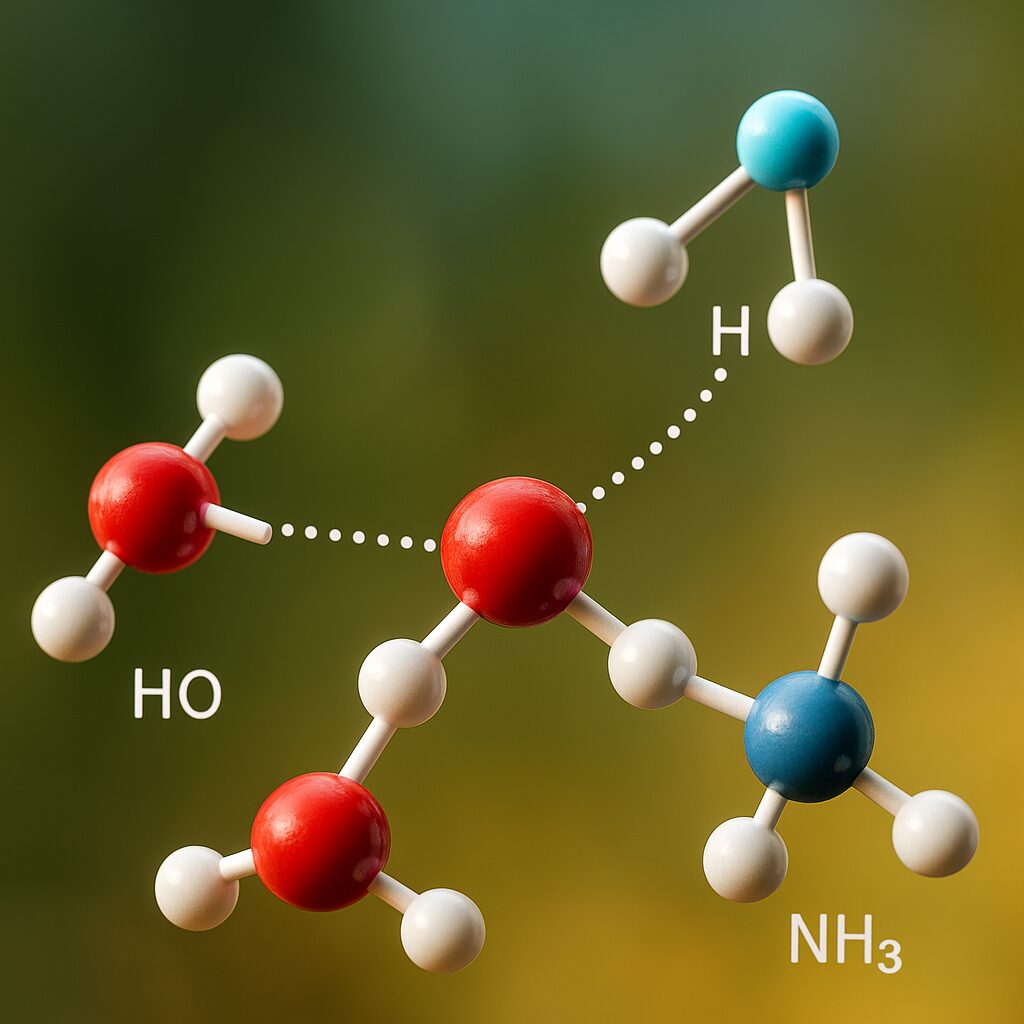
水素結合の例
—身の回りから生命・材料までをつなぐ「弱くて強い」結びつき—
はじめに
物質の性質は、原子や分子どうしの結びつきによって大きく変わります。共有結合やイオン結合のような「強い結合」だけでなく、分子同士が引き合う「弱い相互作用」も重要です。その代表が水素結合です。水素結合は一つひとつの力は弱いものの、たくさん集まると驚くほど大きな効果を生み、液体の水のふるまいからDNAの安定性、衣料用繊維の強度にまで影響を与えます。ここでは、水素結合の仕組みと条件、典型例・弱い例・ほとんど起こらない例、さらに生活・生命・材料科学での具体的な役割まで、ていねいに解説します。
水素結合とは何か
水素結合とは、電気陰性度の高い原子(主にF・O・N)に結びついた水素原子(H)が、近くの分子の孤立電子対をもつ原子に弱く引き寄せられる相互作用です。
- 水素結合を与える側をドナー(例:O–H、N–H、F–H を含む部位)、
- 受け取る側をアクセプター(例:酸素や窒素の孤立電子対をもつ部位)
と呼びます。
共有結合やイオン結合に比べて弱い相互作用ですが、数が多いほど全体として大きな安定化をもたらす性質(相乗・協同効果)があります。したがって、分子の立体構造や凝集状態、融点・沸点・溶解度・表面張力などの物性に強く影響します。
水素結合が生まれる条件
水素結合には基本となる二つの条件があります。
- H が F・O・N など電気陰性度の高い原子に共有結合していること
→ 電子が引き寄せられ、H 原子側が部分的に正(δ+)に偏ります。 - 近くに孤立電子対をもつ原子があること(たとえば O や N)
→ その電子対が δ+ の H を引き寄せ、方向性のある相互作用が生まれます。
この二つが満たされると、H…O や H…N のような点線で表す結びつきが形成されます。水素結合は距離・角度に敏感で、一直線に近いほど強い傾向があります。
代表例:強い/はっきりした水素結合
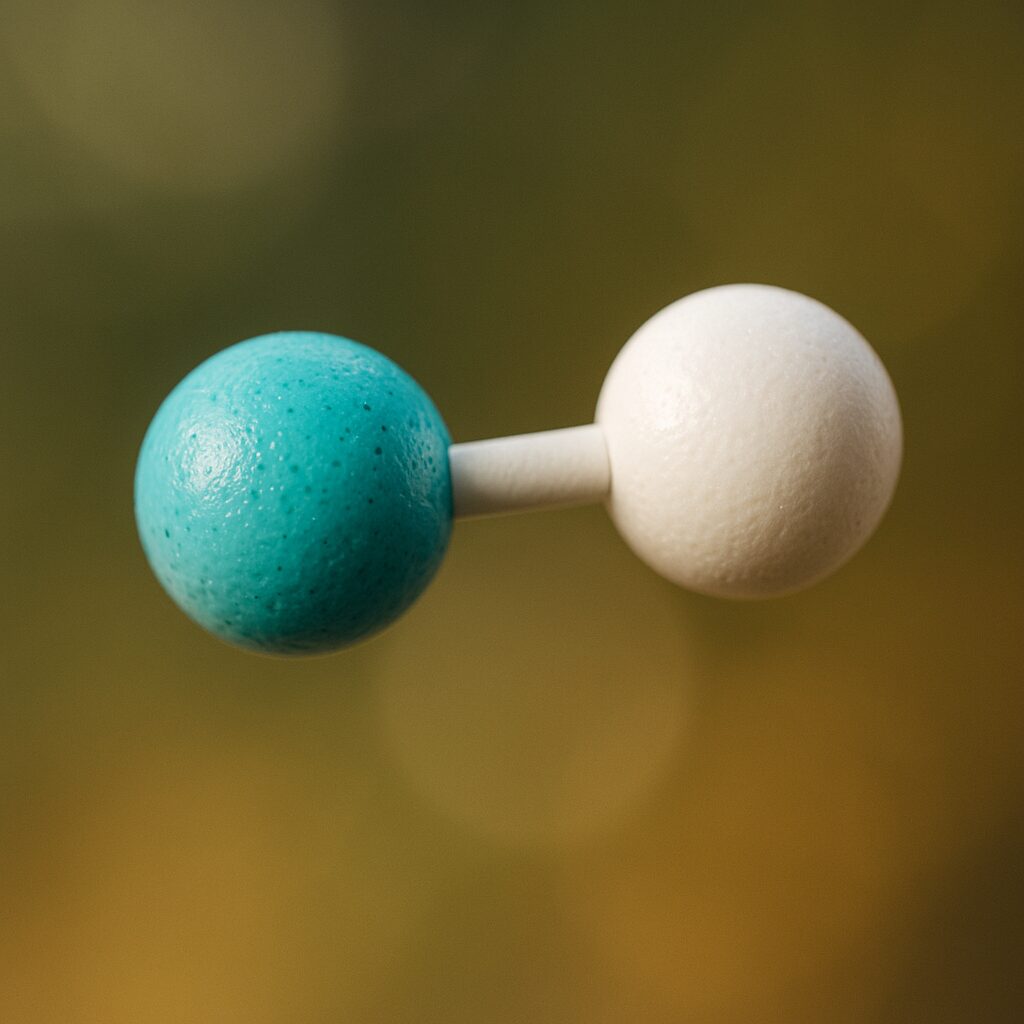
ふっ化水素(HF)
フッ素(F)は最も電気陰性度が高く、H–F 結合は電荷の偏りが非常に大きくなります。このため HF 分子間の水素結合は強く、小さな分子にもかかわらず沸点が高めです。典型例として教科書でも頻出です。
水(H₂O)
水は O–H ドナー と O(孤立電子対)アクセプター の両方を同一分子内にもち、三次元ネットワークを作ります。これにより
- 似た大きさの分子に比べて異常に高い沸点・融点、
- 大きな表面張力や毛細管現象、
- 固体(氷)で密度が下がり水に浮く(開いた格子を作る)
といったユニークな性質が生じます。氷が浮くことで水生生物が生き延びるなど、環境全体に広く影響します。
アンモニア(NH₃)
アンモニアは N–H ドナー と N(孤立電子対)アクセプター を持ち、水素結合を形成します。水ほど強くはありませんが、分子間相互作用の増加により沸点が上昇し、水への高い溶解性にも寄与します。
アルコール類(例:エタノール)
O–H を含み、他分子の O の孤立電子対と結びつくため、水素結合を作ります。これが水と混ざりやすい(相溶)理由の一つです。沸点・蒸気圧・粘性などにも影響します。
カルボン酸(例:酢酸)
カルボン酸は 分子間二量体(ダイマー)を作りやすく、O–H…O=C の強い水素結合が二つ同時に形成されます。これにより沸点が大きく上昇します。
生命における水素結合

DNA の二重らせん
塩基対 A–T と G–C は、それぞれ2本・3本の水素結合で特異的に結びつき、二重らせんを安定化します。水素結合は強すぎず弱すぎないため、複製や転写のときにほどけ、ふだんは情報を守るという絶妙なバランスが保たれます。
タンパク質の立体構造
主鎖の C=O…H–N 間に多数の水素結合が生じ、αヘリックスやβシートを安定化します。側鎖間の水素結合も活性部位の精密な形づくりに関与し、酵素反応の選択性・速度に影響します。
材料における水素結合
ナイロン(ポリアミド)を中心に
ナイロンなどの**–CONH–(アミド結合)**を持つ高分子では、鎖と鎖の間で N–H…O=C の水素結合が多数形成され、
- 高い引張強度・耐摩耗性、
- 融点・ガラス転移温度の上昇、
- 吸湿による性質変化(しなやかさの増減)
などが生じます。ポリエステルやポリウレタンでも部位に応じて水素結合が関与し、繊維の風合い・耐久性が決まります。
セルロース・デンプンなど
天然高分子でも、多数の –OH 基が水素結合ネットワークを作り、結晶化度や機械特性、吸湿性を左右します。紙のコシや木材の強さにも、水素結合が深く関わります。
弱い/特殊な水素結合の例
クロロホルム(CHCl₃)
C–H の水素は δ+ が小さく、水素結合はごく弱いのが一般的です。ただし強いアクセプター(カルボニル酸素など)が近い場合、弱い C–H…O 型の水素結合が観測されることがあります。結晶構造や溶液中の分子会合で議論される、やや上級者向けの例です。
アセチルアセトン(acac)
ケト–エノール互変異性を示し、エノール形では O–H…O の分子内水素結合で六員環を作って安定化します。分子内に閉じた形のため、溶解性や配位子としての性質に影響します。
硫黄を含む化合物(チオールなど)
–SH は –OH に比べて電気陰性度が低く極性が小さいため、S–H…S / S–H…O の水素結合は弱いことが多いです。H₂S は分子間水素結合をほとんど作らず、水に比べて沸点が低い理由の一つになります。
水素結合をほとんど作らないもの
窒素分子(N₂)、酸素分子(O₂)
非極性の二原子分子で、H ドナーもアクセプターも持ちません。したがって水素結合は生じません。
メタン(CH₄)・二酸化炭素(CO₂)など
C–H は δ+ が小さく、CO₂ は直線分子で全体として非極性です。いずれも水素結合には不向きです(CO₂ の酸素は孤立電子対を持ちますが、分子全体の極性や幾何によって一般に水素結合性は低いままです)。
※「起素」と表記されることがありますが、文脈上は窒素の誤記として扱われる場合があります。ここでは窒素分子 N₂ は水素結合をほとんど作らないことを示しました。
なぜ「弱い力」が大きな効果を生むのか
水素結合は、
- 多数が同時に働く協同効果、
- 方向性のある相互作用(一直線に近いほど有利)、
- 温度・溶媒に敏感(加熱で切れ、冷却で増える)
といった特徴をもちます。氷の格子、DNA の塩基対、タンパク質の折りたたみ、繊維の結晶化などでは膨大な数の水素結合が同時に働き、全体として強い安定化を与えます。
生活の中の水素結合
- お茶やコーヒーの香り:香り分子が水と相互作用し、温度上昇で水素結合が一部切れると揮発が進み香りが立つように感じられます。
- 表面張力・水滴:水分子の水素結合ネットワークが水面を張らせ、水滴が球状を保ちます。
- 洗浄:洗剤の親水基は水と、疎水基は油と相互作用します。親水基の水素結合性が再付着防止や分散を助けます。
- 食品・ゲル:ゼラチンや寒天のゲル形成では、分子間の水素結合が網目構造を支え、食感や保水性を決めます。
科学・技術での応用
- 医薬品設計(ドラッグデザイン):薬が標的タンパク質に正確に結合する鍵として、ドナー/アクセプター配置が緻密に設計されます。
- 結晶工学・超分子化学:水素結合はホスト–ゲスト集合や自己組織化のガイドとして使われ、多孔性材料・結晶多形の制御に役立ちます。
- 接着・コーティング:基材表面の官能基(–OH、–CONH– など)との多数の水素結合が、密着性や耐久性に寄与します。
- 高分子ブレンド:異なるポリマー間でも相補的な水素結合部位を設計すると、相溶化・微細相分離の制御が可能になります。
よくある誤解と正しい見方
- 「水素を含むなら何でも水素結合する?」
いいえ。H が F・O・N に結合していること、相手に孤立電子対があることが必要です。 - 「HCl は強酸だから水素結合が強い?」
いいえ。H–Cl は極性はあるものの、F・O・N と比べ水素結合能は低く、溶液中では別の相互作用が支配的です。HFが強いのはF の電気陰性度ゆえです。 - 「硫黄(–SH)でも –OH と同じ?」
いいえ。S は O より電気陰性度が低く、–SH の水素結合は一般に弱いです。
具体例の整理(ご参考)
- 強く・はっきり:HF、H₂O、NH₃、アルコール、カルボン酸、タンパク質、DNA、ナイロン(ポリアミド)
- 弱い/条件つき:クロロホルム(C–H…O 型)、アセチルアセトン(分子内 O–H…O)、チオール類(–SH)
- ほとんどしない:N₂、O₂、CH₄、CO₂(全体として非極性・幾何的理由)
まとめ
水素結合は、F・O・N に結びついた水素と孤立電子対とのあいだで生じる、方向性のある弱い相互作用です。弱いにもかかわらず、数が集まることで水や氷の特性、DNA とタンパク質の安定性、繊維やプラスチックの機械特性など、自然から工業・医療に至るまで幅広い場面を左右します。
ふっ化水素・水・アンモニアは教科書的な代表例で、タンパク質・DNA・ナイロンは応用・実在系での重要例です。一方で、クロロホルムやアセチルアセトン、チオールは「弱い」「特殊」「分子内」といった多様性を示し、窒素分子や酸素分子は水素結合をほとんど作りません。
身の回りにある現象の裏側では、目に見えない水素結合が静かに、しかし決定的に働いています。仕組みと条件を理解すると、液体の水のふるまいから最先端材料の設計まで、一本の線で見通せるようになります。









